Intro
I- Réactions sous contrôle thermodynamique
1/ Définition : schéma Energie / CR
2/ Exemples
II- Réactions sous contrôle cinétique
1/ Définition : schéma Energie / CR
2/ Exemples dans le modèle de Lewis
3/ Exemples dans le modèle des orbitales frontières
Conclusion
En version plus
développée...
Intro :
Pour prévoir le produit final d'une réaction, alors qu'un choix éventuel est possible pour le produit de réaction, on peut classer , grâce à l'observation de résultats expérimentaux, et l'analyse des mécanismes, les réactions : elles peuvent être soit sous contrôle cinétique, soit sous contrôle thermodynamique. Connaissant le classement d'une réaction, on peut alors analyser les réactifs et prédire le produit majoritairement obtenu.
I- Réactions sous contrôle thermodynamique
1/ Définition : schéma Energie / CR
Un réaction sous contrôle thermodynamique est une réaction qui fournit, majoritairement , indépendamment des états de transition ou intermédiaires réactionnels possibles, le produit le plus stable. C'est en étudiant les énergies relatives des produits finaux envisageables que l'on trouve le produit majoritaire : le plus stable.
Mettre ici les schémas réactionnels qui montrent le critère de choix :
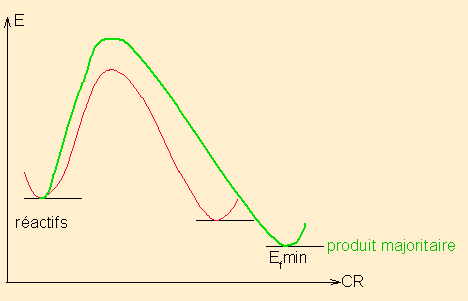 pour une réaction en 1 étape ( pas d'IR)
pour une réaction en 1 étape ( pas d'IR)ou
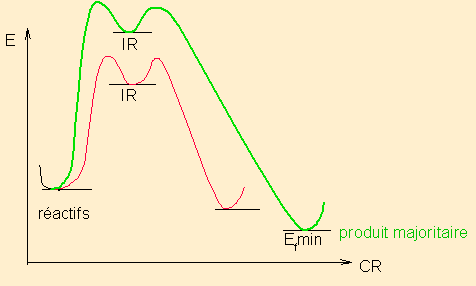 pour une réaction en deux étapes ( 1 ou 2 IR, peu importe)
pour une réaction en deux étapes ( 1 ou 2 IR, peu importe)2/ Exemples
- Elimination E2 de HBr à partir d'un dérivé halogéné....bien choisir son exemple...voir ici en complétant par les espèces.
- E1 est aussi sous contrôle thermodynamique, modifier le schéma en faisant apparaitre un intermédiaire réactionnel unique ( le carbocation )
Pour prévoir l'alcène obtenu, on compare les stabilités des alcènes possibles .
Un alcène est d'autant plus stable que :
1- Il est aromatique
(mais ce n'est même plus un alcène...)
2- Il est stabilisé
par résonance, avec une longue chaîne de délocalisation3- Il porte des groupes alkyl (on le dit substitué)
- Les déshydratations : Ce sont des éliminations et elles obéissent aux mêmes règles . Choisir l'exemple de la crotonisation éventuellement...( ou une autre )
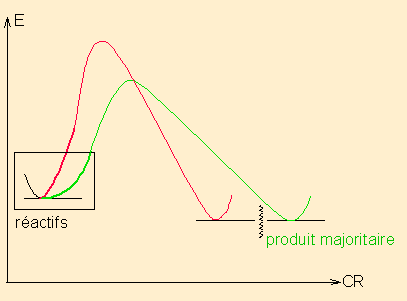
1/ Définition : schéma Energie / CR
Une réaction sous contrôle cinétique est une réaction qui fournit majoritairement le produit issu de l'intermédiaire réactionnel ( ou de l'état de transition si une seule étape) le plus stable, selon le processus le plus rapide, via l'énergie d'activation la plus basse, indépendamment des énergies relatives des produits finaux possibles.
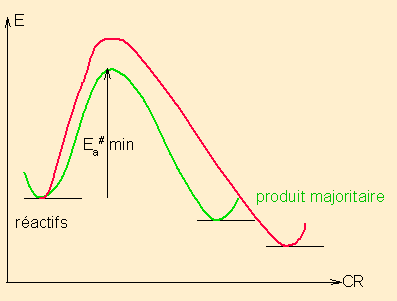 pour une réaction en 1 étape
pour une réaction en 1 étapeou
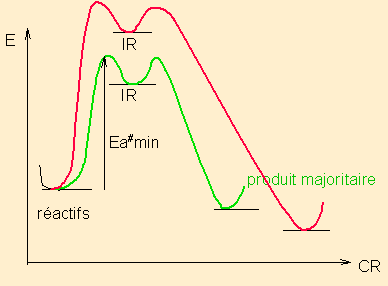 pour une réaction en deux étapes
pour une réaction en deux étapes2/ Exemples dans le modèle de Lewis
- addition électrophile de HX ou HOX ou H2O sur les alcènes ( choisir le 2 méthyl propène )
- addition radicalaire de HBr sur les alcènes, polymérisation radicalaire des alcènes
- polymérisation anionique des alcènes ( choisir le styrène)
- Substitution électrophile sur un benzène déjà substitué ( choisir l'anisole , ortho para orienteur , en version résumée )
Toute réaction interpréptée dans le modèle des OF est sous contrôle cinétique. En effet le raisonnement fait sur l'approche majoritaire pour un recouvrement maximal entre atomes de plus gros coefficients revient à choisir le recouvrement le moins couteux en énergie en début de réaction soit :
 La zone rectangle préfigure l'ordre des états de transition et donc l'Ea la plus faible
La zone rectangle préfigure l'ordre des états de transition et donc l'Ea la plus faible- Diels Alder du penta 2,4 diénal sur le 1-méthoxy éthylène ( approche 5 ( gros coeff BV) : 2 ( gros coeff HO) majoritaire ) .
- Addition d'un cuprate lithié dur le propénal sous contrôle orbitalaire (action sur le C3 (gros coeff BV ) majoritaire ) .
Une réaction sous contrôle cinétique doit être menée rapidement et à température ambiante pour donner le produit cinétique. Elle peut fournir le produit thermodynamique si elle est menée à haute température , pendant longtemps, par mise en équilibre, un équilibre donnant toujours majorotairement le produit le plus stable. Le produit cinétique est alors minoritaire.
Il existe des réactions sous contrôle stérique ( exemple de l'hydroboration ) .