Intro
I- Analyse du dosage
1/ Les volumes équivalents
2/ Allure prévisible de la courbe
3/ Calculs de pH particuliers
II- Dosage expérimental et exploitation
1/ Le montage
2/ Détermination des volumes équivalents
3/ Choix des indicateurs colorés
Conclusion
En version plus
développée...
Intro :
On donne l'axe de prédominance des espèces de l'acide phosphorique.
On choisit arbitrairement une solution d'étude de concentration connue : 20 mL à 0,1 mol.L-1 dosés par OH- molaire ( cad à 1 mol.L-1 ) .
Remarque : il existe des microburettes capables de mesurer avec précision des volumes faibles.
I- Analyse du dosage
1/ Les volumes équivalents
- Les réactions successives de dosage
H3PO4 + OH- = H2PO4- + H2O K = KA1 / Ke = 1011,9 Totale, adaptée au dosage
H2PO4- + OH- = HPO42- + H2O K = KA2 / Ke = 106,8 Totale, adaptée au dosage
HPO42- + OH- = PO43- + H2O K = KA3 / Ke = 101,9 NON strictement totale... problèmes prévisibles.
- Calculs des volumes équivalents
Donc Véq1 = 2 mL, Véq2 = 4 mL, Véq3 > 6 mL car la 3° réaction de dosage n'est pas strictement totale.
2/ Allure prévisible de la courbe
On peut travailler sur l'axe de prédominance pour prévoir l'allure :
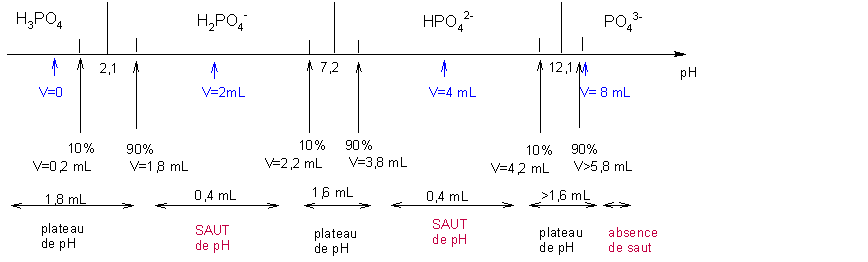
IMPORTANT : on fait remarquer qu'en raison du pKA3 trop élevé de l'acide phosphorique, le dosage de la troisième acidité TROP FAIBLE n'est pas VISIBLE , du tout, puisque entre la fin du plateau à 13,1 , et le pH maximum atteignable ( ou lisible par une électrode de pH ) , il n'y a RIEN en unité pH => 2 sauts de pH uniquement. On peut rajouter ici que pour une précision suffisante, il faut 4 unités entre 2 plateaux, soit un dernier pKA < 9 .
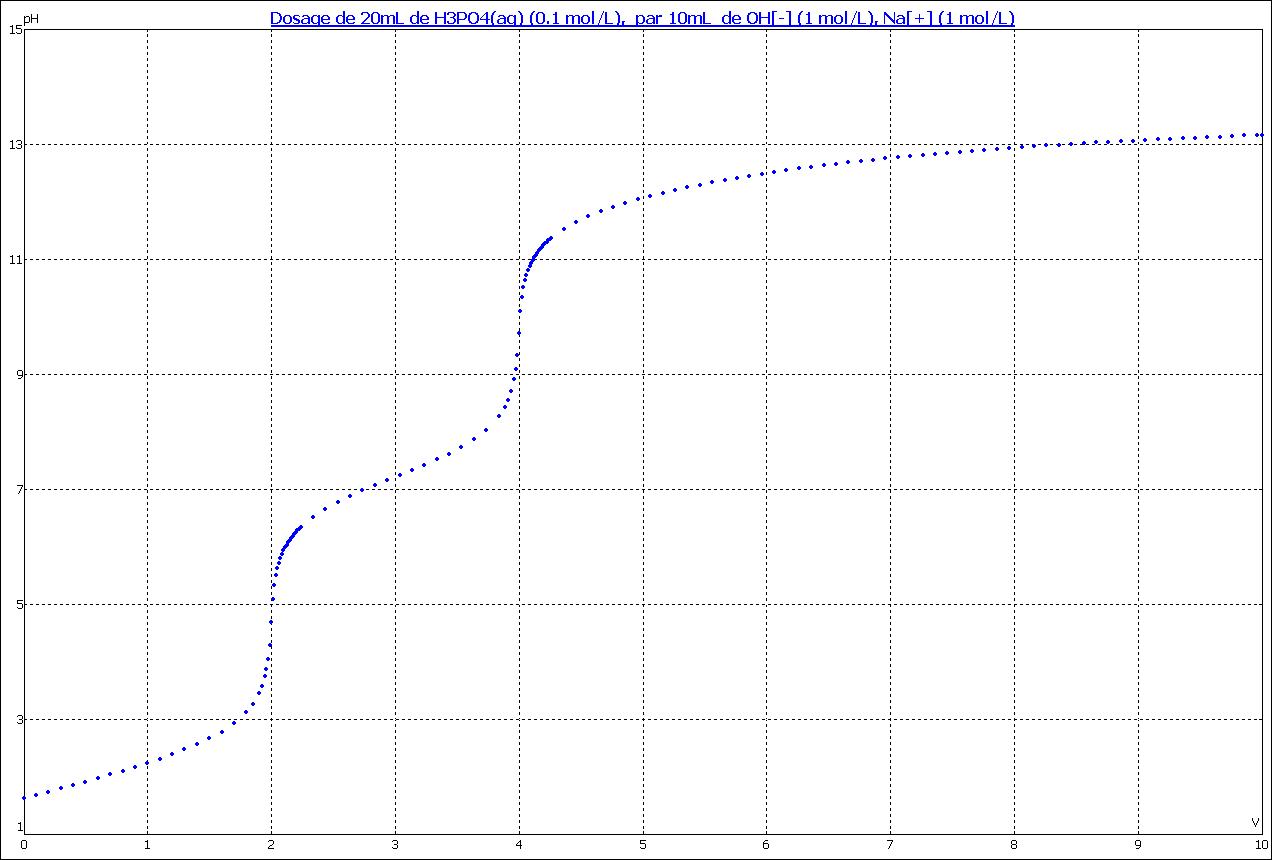
Simultanément au commentaire de cet axe, ou après, on trace l'allure suivante de la courbe ( tracée ici avec Dozzaqueux )
3/ Calculs de pH particuliers
- pH à V = 0
- pH à V=1 mL, 1° 1/2 équivalence
- pH à V=2 mL, 1° équivalence
- pH à V=3 mL, 2° 1/2 équivalence
- pH à V=4 mL, 2° équivalence
- pH à V=5 mL, 3° 1/2 équivalence
- pH à V>6 mL, 3° équivalence
On constate bien que le pH d'équivalence est d'une part très proche du pH de 1/2 équivalence, et d'autre part très proche du pH maximal possible <=> preuve de l'absence de saut.
II- Dosage expérimental et exploitation
1/ Le montage
Electrode de verre + ECS , avec pHmètre ( = voltmètre entre les 2 ) , que l'on étalonnera seulement si on veut relever les valeurs de pH à la 1/2 équivalence
ou alors
Electrode de verre combinée branchée par un cable coaxial sur le pH mètre.
2/ Détermination des volumes équivalents
Méthode des tangentes ou usage de regressi pour obtenir la courbe dérivée et les maximums => véq
On exploitera les 2 sauts visibles pour obtenir un véq moyen, pour plus de précision.
On trouve la concentration de l'acide par la relation : C x 20 = 1 x véq => C = ...
3/ Choix des indicateurs colorés
Si l'on souhaite un dosage colorimétrique, rapide, on peut utiliser des indicateurs colorés.
On choisira préférentiellement des indicateurs colorés dont les pKA sont compris entre 4 et 5 d'une part , et 9,5 et 10,5 d'autre part ( indicateur à chercher dans les tables fournies ) . Suggestion : vert de Crésol , qui vire du jaune au bleu aux alentours de pH = 4,2 , et la thymolphtaléïne qui vire de l'incolore au bleu aux alentours de pH = 9,9 ( attention, l'un ou l'autre, car les couleurs sont incompatibles... )
Conclusion : L'étude de ce dosage permet de montrer :
- la nécessaire différence de pKA de 4 unités pour doser
séparément 2 acidités, pour pouvoir exploiter un saut de pH visible, ce
qui est le cas pour les 2 premières acidités de l'acide phosphorique.
Par exemple , l'acide citrique, triacide aux 3 pKA très proches, voit ses 3 acidités dosées simultanément avec seulement le dernier saut lisible.
- la problématique du dosage des acides trop faibles de pKA > 9 pour lesquels le saut de pH sera trop faible.